Механіка
Елементи СТВ
Молекулярна фізика та термодинаміка
Електродинаміка
- Електричне поле
- Постійний електричний струм
- Електричний струм в різних середовищах
- Магнітне поле
- Електромагнітна індукція
Електромагнітні коливання і хвилі
Оптика
Атомна та ядерна фізика
22.2. СПЕКТРИ ВИПРОМІНЮВАННЯ АТОМІВ І МОЛЕКУЛ
22.3. ПРОТОННО-НЕЙТРОННА МОДЕЛЬ АТОМНОГО ЯДРА
22.4. РАДІОАКТИВНІСТЬ. ЯДЕРНІ РЕАКЦІЇ
22.5. ФІЗИЧНІ ОСНОВИ ЯДЕРНОЇ ЕНЕРГЕТИКИ
22.6. ЕЛЕМЕНТАРНІ ЧАСТИНКИ
22.1. ДОСЛІД Е. РЕЗЕРФОРДА. ПОСТУЛАТИ Н. БОРА. ЕНЕРГЕТИЧНІ РІВНІ В АТОМІ

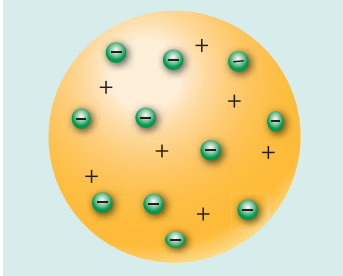
Рис. 22.1. Модель атома Томсона («пудинг із родзинками»)
Одну з перших моделей будови атома запропонував у 1903 р. англійський фізик Джозеф Джон Томсон (1856-1940). Він припустив, що атом має форму кулі; позитивний заряд атома розподілений рівномірно по всьому об’єму цієї кулі, а негативно заряджені електрони вкраплені в її середину (рис.22.1.).
Подальший прогрес у дослідженнях внутрішньої структури атома пов’язаний з ім’ям англійського фізика Ернеста Резерфорда (1871-1937). У дослідах, проведених під його керівництвом у 1908-1911 рр., вивчалося розсіювання α-частинок ядрами Ауруму.
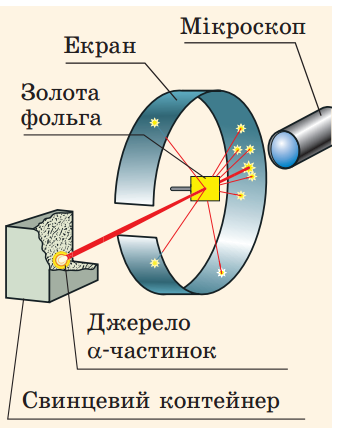
Для дослідів вчені використали α-радіоактивну величину, яку розташували у контейнері з вузьким отвором. Пучок α-частинок із контейнера спрямовувався на тонку золоту фольгу, а далі потрапляв в екран, покритий шаром кристалів цинк сульфіду (рис. 22.2.). Якщо в такий екран влучала α-частика, то в місці її влучання відбувався слабкий спалах світла.

Рис. 22.2. Схема досліду Е. Резерфорда
У результаті дослідів було виявлено:
1) переважна більшість α-частинок проходить крізь золоту фольгу, не змінюючи напрямку свого руху;
2) деякі з α-частинок відхиляються від початкової траєкторії;
3) приблизно одна з 20 000 α-частинок відскакує від фольги, начебто натикаючись на якусь перешкоду.

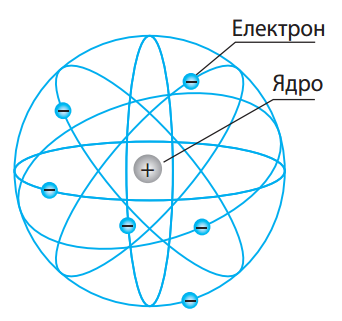
Рис. 22.3. Планетарна модель будови атома Е. Резерфорда
Якби будова атома відповідала моделі Томсона, то α-частинки практично не розсіювалися б, оскільки їх енергія є величезною. Однак під час дослідів Резерфорда деякі α-частинки відхилялися на великі кути. Учений припустив, що розсіювання α-частинок пояснюється тим, що позитивний заряд і маса в атомі не розподілені рівномірно по всьому об’єму атома, а зосереджені в його невеликій центральній частині – ділянці, яку назвали ядро атома. За аналогією з будовою Сонячної системи, нова модель атома була названа планетарною, або ядерною, моделлю (рис. 22.3.).
Планетарна модель атома, блискуче пояснивши результати експериментів із розсіювання α-частинок, разом з тим суперечила класичним законам електродинаміки. Рух планетарною орбітою, як відомо, є рухом із прискоренням (доцентровим), а відповідно до теорії Дж. Максвелла прискорений рух зарядженої частинки супроводжується випромінюванням. Отже, електрон в атомі мав би випромінювати електромагнітні хвилі та відповідно – втрачати енергію. А наслідками цього були б зменшення швидкості руху електрона та його падіння на атомне ядро.
Модифікацію планетарної моделі здійснив у 1913 р. данський фізик Нільс Бор (1885-1962). Він припустив існування в атомі особливих станів електронів. Ці стани визначаються на підставі двох гіпотез, які дістали назву постулати Бора:
1) атомна система може перебувати тільки в особливих стаціонарних (квантових) енергетичних станах, кожному з яких відповідає певне значення енергії; перебуваючи в стаціонарному стані, атом енергію не випромінює.
2) при переході з одного стаціонарного енергетичного стану, що характеризується енергією Еn, в інший з енергією Еm, атом випромінює або поглинає квант електромагнітної енергії, що дорівнює hv = En – Em.
Кількісна теорія, побудована Бором виявилась недостатньою, щоб пояснити випромінювання складних атомів і молекул, – учений зміг побудувати лише теорію випромінювання атома Гідрогену.

