Механіка
Елементи СТВ
Молекулярна фізика та термодинаміка
Електродинаміка
- Електричне поле
- Постійний електричний струм
- Електричний струм в різних середовищах
- Магнітне поле
- Електромагнітна індукція
Електромагнітні коливання і хвилі
Оптика
Атомна та ядерна фізика
7.2. РІВНЯННЯ СТАНУ ІДЕАЛЬНОГО ГАЗУ. ІЗОПРОЦЕСИ
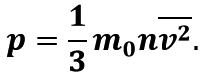
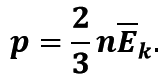
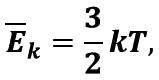

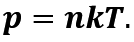
7.1. ОСНОВНЕ РІВНЯННЯ MKT ІДЕАЛЬНОГО ГАЗУ. ТЕМПЕРАТУРА І СЕРЕДНЯ КІНЕТИЧНА ЕНЕРГІЯ МОЛЕКУЛ
Ідеальний газ – це фізична модель газу, молекули якого приймають за матеріальні точки, що не взаємодіють одна з одною на відстані та пружно взаємодіють у моменти зіткнення.

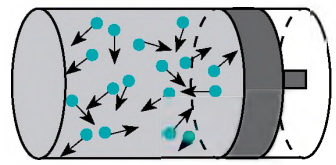
Тиск газу зумовлений ударами його молекул. Перебуваючи в безперервному хаотичному русі, молекули газу зіштовхуються зі стінками посудини і поверхнею будь-якого тіла в газі, діючи на них з деякою силою. Сумарна сила дії частинок на одиницю площі поверхні і є тиском газу.
Рівняння залежності тиску р ідеального газу від маси m0 його молекул і середнього квадрата швидкості v2 їх руху – це основне рівняння молекулярно-кінетичної теорії ідеального газу:
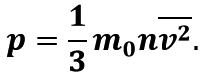
Тут n – концентрація молекул газу – фізична величина, яка дорівнює числу молекул в одиниці об’єму газу.
Основне рівняння МКТ ідеального газу можна записати і так:
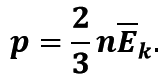
Фізична величина, яка характеризує стан теплової рівноваги макроскопічної системи, називається температурою.
Одиниця абсолютної температури – кельвін (К) – основна одиниця СІ. Температури за шкалами Кельвіна і Цельсія пов’язані співвідношеннями: T=t + 273; t = T - 273.
Середня кінетична енергія поступального руху молекул ідеального газу прямо пропорційна абсолютній температурі:
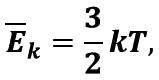
де k – стала Больцмана – коефіцієнт пропорційності, який не залежить ані від температури, ані від складу та кількості газу.

Якщо газ охолодити до температури Т = 0 К, рух його молекул має припинитися. Таким чином, нульова точка шкали Кельвіна – це найнижча теоретично можлива температура. Насправді рух молекул не припиняється ніколи, тому досягти температури 0 К (- 273 °С) неможливо.
Абсолютну нижню межу температури, за якої рух молекул і атомів має припинитися, називають абсолютним нулем температури.
Тиск р газу повністю визначається його абсолютною температурою Т і концентрацією n молекул газу: