Механіка
Елементи СТВ
Молекулярна фізика та термодинаміка
Електродинаміка
- Електричне поле
- Постійний електричний струм
- Електричний струм в різних середовищах
- Магнітне поле
- Електромагнітна індукція
Електромагнітні коливання і хвилі
Оптика
Атомна та ядерна фізика
22.1. ДОСЛІД Е. РЕЗЕРФОРДА. ПОСТУЛАТИ Н. БОРА. ЕНЕРГЕТИЧНІ РІВНІ В АТОМІ
22.2. СПЕКТРИ ВИПРОМІНЮВАННЯ АТОМІВ І МОЛЕКУЛ
22.4. РАДІОАКТИВНІСТЬ. ЯДЕРНІ РЕАКЦІЇ
22.5. ФІЗИЧНІ ОСНОВИ ЯДЕРНОЇ ЕНЕРГЕТИКИ
22.6. ЕЛЕМЕНТАРНІ ЧАСТИНКИ
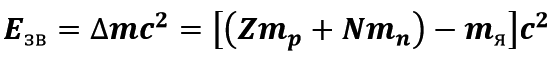
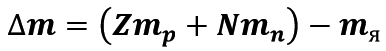
22.3. ПРОТОННО-НЕЙТРОННА МОДЕЛЬ АТОМНОГО ЯДРА
Атомне ядро складається із частинок двох видів: протонів, які мають позитивний електричний заряд, і нейтронів, які не мають заряду.
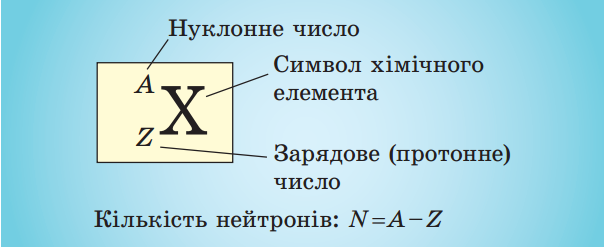
Протони і нейтрони, що входять до складу ядра атома, називають нуклонами.

Сумарну кількість протонів і нейтронів в атомі називають нуклонним (масовим числом) і позначають символом А.
Кількість протонів у ядрі називають зарядовим (протонним) числом і позначають символом Z.
Кількість нейтронів у ядрі N = А - Z .
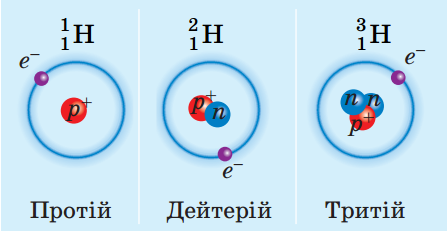
Ізотопи – атоми того самого хімічного елемента, ядра яких містять однакове число протонів, але різну кількість нейтронів.

Наприклад, є три ізотопи Гідрогену: ядро найлегшого ізотопу Гідрогену містить 1 протон; ядро атома другого ізотопу Гідрогену – Дейтерію – містить 1 протон і 1 нейтрон; ядро третього ізотопу Гідрогену – Тритію – містить 1 протон і 2 нейтрони.
Сили, які діють між протонами й нейтронами в ядрі та забезпечують існування атомних ядер, називають ядерними силами.
Енергію, необхідну для повного розщеплення ядра на окремі нуклони, називають енергією зв'язку атомного ядра (Езв):
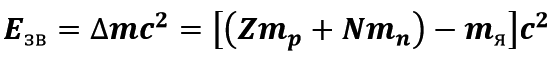
Величина
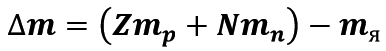
отримала назву дефект мас.

