Механіка
Елементи СТВ
Молекулярна фізика та термодинаміка
Електродинаміка
- Електричне поле
- Постійний електричний струм
- Електричний струм в різних середовищах
- Магнітне поле
- Електромагнітна індукція
Електромагнітні коливання і хвилі
Оптика
Атомна та ядерна фізика
7.1. ОСНОВНЕ РІВНЯННЯ MKT ІДЕАЛЬНОГО ГАЗУ. ТЕМПЕРАТУРА І СЕРЕДНЯ КІНЕТИЧНА ЕНЕРГІЯ МОЛЕКУЛ
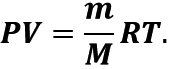
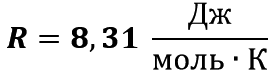
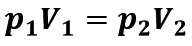
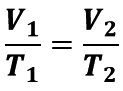
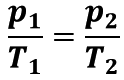
7.2. РІВНЯННЯ СТАНУ ІДЕАЛЬНОГО ГАЗУ. ІЗОПРОЦЕСИ
Рівняння стану ідеального газу (рівняння Менделєєва – Клапейрона):
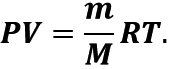
Добуток числа Авоґадро ΝΑ на сталу Больцмана k називають універсальною газовою сталою (R):
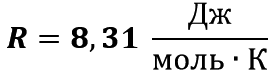
Процес, у ході якого один із макроскопічних параметрів даного газу деякої маси залишається незмінним, називають ізопроцесом.

Ізотермічний процес - процес змінювання стану даного газу деякої маси, що відбувається за незмінної температури. Нехай деякий газ переходить зі стану (р1,V1,Т) у стан (р2, V2, Т), тобто температура газу залишається незмінною.
Закон Бойля-Маріотта:
Для даного газу деякої маси добуток тиску газу на його об'єм є незмінним, якщо температура газу не змінюється:
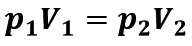

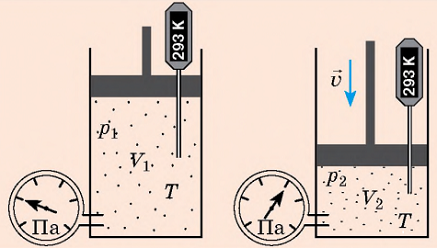
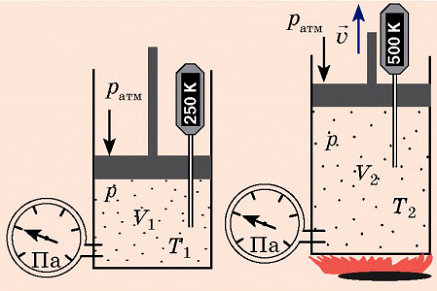
Ізобарний процес - процес змінювання стану даного газу деякої маси, що відбувається за незмінного тиску. Нехай деякий газ переходить зі стану (р,V1,Т1) у стан (р, V2, Т2), тобто тиск газу залишається незмінним.
Закон Ґей-Люссака:
Для даного газу деякої маси відношення об'єму газу до температури є незмінним, якщо тиск газу не змінюється:
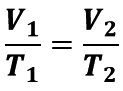

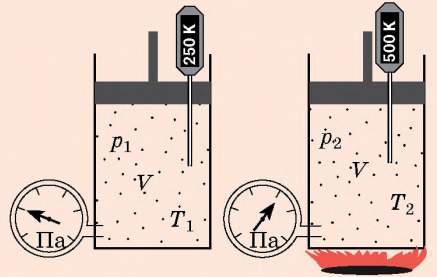
Ізохорний процес - процес змінювання стану даного газу деякої маси, що відбувається за незмінного об'єму. Нехай деякий газ переходить зі стану (р1,V,Т1) у стан (р2, V, Т2), тобто об’єм газу не змінюється.
Закон Шарля:
Для даного газу деякої маси відношення тиску газу до його температури є незмінним, якщо об'єм газу не змінюється: