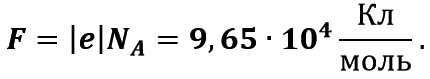Механіка
Елементи СТВ
Молекулярна фізика та термодинаміка
Електродинаміка
- Електричне поле
- Постійний електричний струм
- Електричний струм в різних середовищах
- Магнітне поле
- Електромагнітна індукція
Електромагнітні коливання і хвилі
Оптика
Атомна та ядерна фізика
14.1. ЕЛЕКТРИЧНИЙ СТРУМ У МЕТАЛАХ
14.3. ЕЛЕКТРИЧНИЙ СТРУМ У ГАЗАХ
14.4. ЕЛЕКТРОПРОВІДНІСТЬ НАПІВПРОВІДНИКІВ
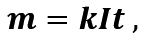
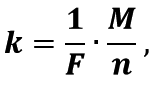
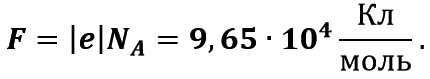
14.2. ЕЛЕКТРИЧНИЙ СТРУМ В ЕЛЕКТРОЛІТАХ
Електроліти – це тверді або рідкі речовини, що мають йонну провідність.
Прикладами є водні розчини солей, кислот або лугів. Під час розчинення у воді солей, кислот або лугів нейтральні молекули цих речовин можуть розпастися на окремі йони. Це явище називають електролітичною дисоціацією.
Електричний струм у розчинах і розплавах електролітів являє собою напрямлений рух вільних йонів.
Процес виділення речовин на електродах, пов’язаний з окисновідновними реакціями, що відбуваються на електродах під час проходження струму, називають електролізом.
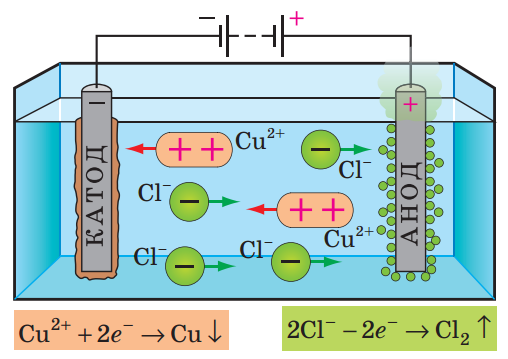
Якщо через водний розчин купрум хлориду протягом кількох хвилин пропускати струм (рис. 14.1), то поверхню катода вкриє тонкий шар міді, а біля анода виділиться газоподібний хлор.

Рис.14.1. Електроліз розчину купрум хлориду
Перший закон електролізу (перший закон Фарадея):
Маса m речовини, яка виділяється на електроді під час електролізу, прямо пропорційна силі струму І та часу t його проходження через електроліт:
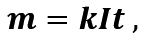
де k – електрохімічний еквівалент речовини.
Одиниця електрохімічного еквівалента в СІ – кілограм на кулон.
Другий закон електролізу (другий закон Фарадея):
Електрохімічний еквівалент k речовини прямо пропорційний відношенню молярної маси елемента до валентності цього елемента в даній хімічній сполуці.
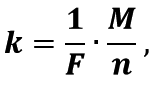
де F – стала Фарадея.